比色計對物質顏色的對比及研究
物質的顏色,我們從剛開始的物質,到后來的慢慢的認識,經歷了很多的過程,無論在理論上還是在實踐上都是一個重要的問題,這種對物質顏色的研究,也為我們帶來了很多的便利,諸如隱形飛機的研究就是利用物質顏色的原理。在普通化學、無機化學和分析化學的數學中也經常接觸無機物的顏色。本文借助比色計對物質進行比色測量,然后對物質顏色的產生特點,物質頗色與結構的關系以及無機物顏色的規律進行對比研究和討論。
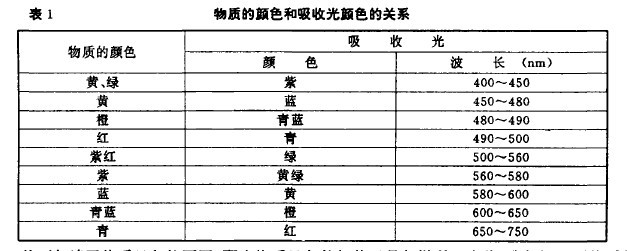
物質的顏色和光是密切聯系的。可見光是波長為400nm—760nm的電磁波,不同波長的可見光作用于人的肉眼,其視覺反映的顏色感覺是不相同的。可見光中,各種不同波長的光線反映的顏色稱為光譜色,當不同波長的光線同時照射物質時,如完全反射,則該物質為白色;如完全吸收,則該物質為黑色。只有當物質選擇吸收可見光線中某一波段的光線,反射其余各波段的光線,物質才是有色的。所以,化合物顯色的原因在于它吸收并反射可見光。顏色與物質的結構也是密切聯系的。物質吸收光時,化合物的電子在可見光譜中相應能量的光量子的作用下被激發,它的電子能態和基態間的能量差就是所吸收的相應光量子的能量。物質不僅能吸收可見光中具有一定波長的光而本身被激發。而且能散射(向各個不同的方向反射)其他波長的光,其中散射的顯色的光,就是被吸收的光的顏色的補色光。物質吸收光的顏色與顯色的關系見表1。例如,HgS吸收紫光和藍光,它所顯示的顏色就是它們的補色,即黃綠色。因此,只要化合物的電子的基態和激發態之間的能量差在可見光的能量范圍內,物質就能顯色。兩個能態的能量差愈小,吸收頻率愈低(波長愈長)的光,呈現的顏色就愈深,反之愈淺。如果兩個能態的能量差大于可見光的能量,那么,電子由于不能被可見光激發,物質就不呈現顏色。
羅維朋比色計進行比色結果證明,物質是否顯色,決定于物質能否吸收可見光;而物質顯什么顏色,決定于它們的結構,即決定于基態和激發態的能量差;而顏色的強度則決定于能級躍遷的幾率和能級退化性的數目。
前面僅談了物質顯色的原因,那么物質顯色的規律又是怎樣呢?為此,我們深入到物質的結構,討論其顯色的規律。大多數過渡元素配合物是有顏色的,這是因為在配位體場的影響下,過渡金屬離子的d軌道發生了分裂所引起的。對于電子構型不飽滿的金屬離子,在吸收了一部分光能后,就可以使未成對的電子從低能級的d軌道向高能級的d軌道躍遷,即所謂的d—d躍遷,相當于可見光的波長。作為經驗規則:d—d躍遷往往得出淺色,而荷移躍遷則得深色。離子極化對無機化合物的顏色有很大影響,它總是加深化合物的顏色。極化程度愈大,顏色變得愈深。因為離子極化使體系趨于更穩定,能量較高的電子激發態和能量較低的電子的基態都由于極化而降低勢能。然而能量較高的激發態軌道半徑較大,其極化率也就相應較大,極化對激發態的影響比起基態顯得更大,使之降低的能量比基態大得多。因此,離子極化的總效應使激發態與基態更加接近,它們之間的能量差減小,故物質對光的特征吸收就隨著極化作用的加強而向較長波段移動,致使顏色逐步加深。一般說來,比較測色儀顯示,離子若無顏色,則所生成的化合物往往也是無色的,離子若有顏色,它的化合物就會有顏色。但常常也有這樣的現象,無色離子構成了有色化合物,如無色的Ag+和無色的I—離子生成了黃色的AgI,這是由于離子極化所造成的。這就與陽離子的極化力和陰離子的變形性有關。
最后應當指出,影響無機化合物顏色的因素是比較復雜的,而且影響因素也很多。如物質的聚集狀態、分散度、溫度、溶解度和微量雜質存在等都會影響物質的顏色。




